INVESTIGACIÓN DE CORPÚSCULOS DE NEGRI
INTRODUCCIÓN
En
el diagnóstico de laboratorio de la rabia las técnicas empleadas deben ofrecer
condiciones óptimas de precisión, rápidez y economía, ya que es una enfermedad
zoonótica la cual produce terrible sufrimiento a las víctimas de la infección y
que además luego de la presentación de los síntomas la enfermedad resulta
invariablemente fatal.
Cumplen
con éstos requisitos las siguientes técnicas:
·
Investigación
microscópica de corpúsculos de Negri, que consiste en realizar Tinción de
Seller a improntas de tejido encefálico sospechoso.
·
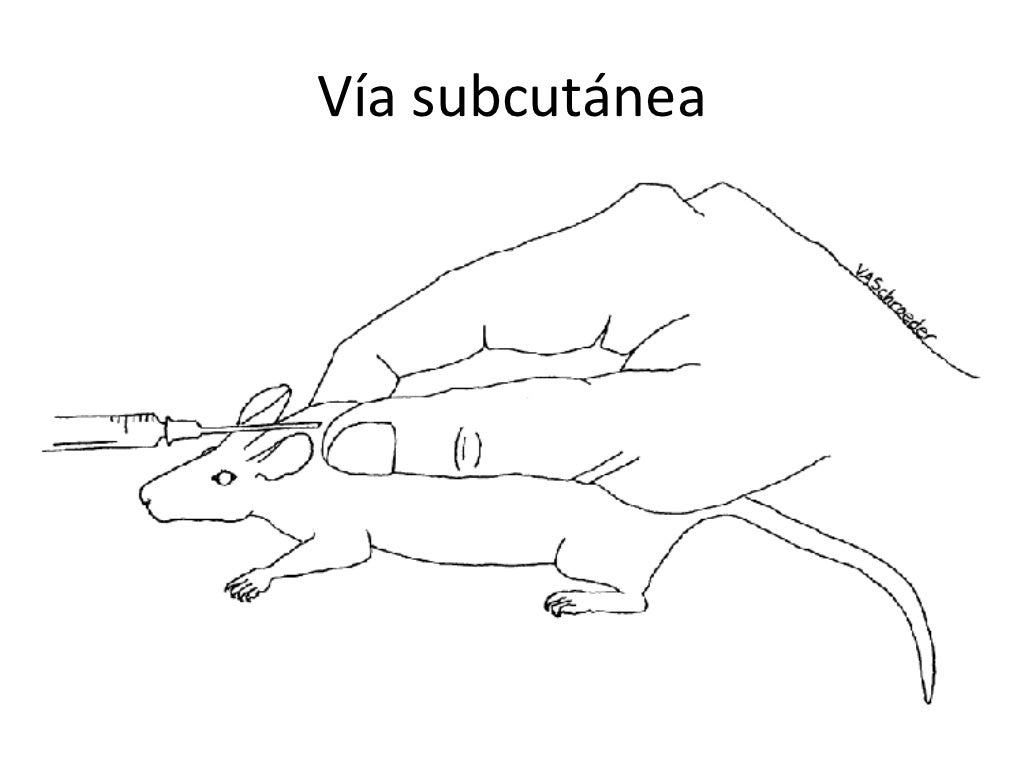
Prueba Biológica: que
consiste en realizar inoculación intracerebral a ratones de 3 días de edad de
una suspensión de 10-20% de material encefálico sospechoso.
·
Prueba de anticuerpos
fluorescentes.
OBJETIVOS
1. Reconocer la importancia de la tinción de Seller para el
diagnóstico de la rabia.
2. Conocer cómo se lleva a cabo la técnica
3. Observar placas positivas a la tinción de Seller.
4. Demostrar la importancia del cumplimiento de las normas de
Bioseguridad durante el desarrollo de técnicas de diagnóstico que implican alto
riesgo.
PROCEDIMIENTO
Preparación de las soluciones madres y el
tinte:
a. Solución A: a un litro de metanol absoluto añada 10 gr de
azul de metileno, guarde en envase de vidrio ámbar.
b. Solución B: a 500ml de metanol absoluto añada 5gr de
fuchsina básica, deposite en envase de vidrio ámbar.
c. La solución del tenido se prepara 2 partes de solución A
más una parte de la Solución B. Se debe homogenizar amabas soluciones más no
filtrarlas. Se recomienda esperar hasta 24 horas antes de su utilización.
Preparación de las Improntas:
a. Muestras de hipocampus, corteza y cerebelo se seccionan con
un bisturí.
b. Se colocan sobre depresores cuidando de que la superficie
recién cortada quede arriba.
c. Utilizando portaobjetos completamente limpios se tocan las
superficies seccionadas del tejido haciendo una ligera presión. Esto provocará
que quede adherida a la superficie del portaobjetos una capa sumamente delgada
de tejido de la muestra.
d. Pueden hacerse de tres a cuatro improntas por placa.
e. Aún húmeda la placa se cubre con el tinte.
f. Se espera unos segundos y se enjuaga con agua común.
g. Luego del enjuague se dejan secar.
h. De gran importancia es el conocimiento de algunas
modificaciones de ésta tinción, la más ampliamente utilizada es la tinción
modificada de Lentz.
i. El examen de las placas se realiza primero bajo objetivos
de bajo poder, luego de localizadas las áreas que contienen numerosas neuronas
se selecciona el objetivo de inmersión.
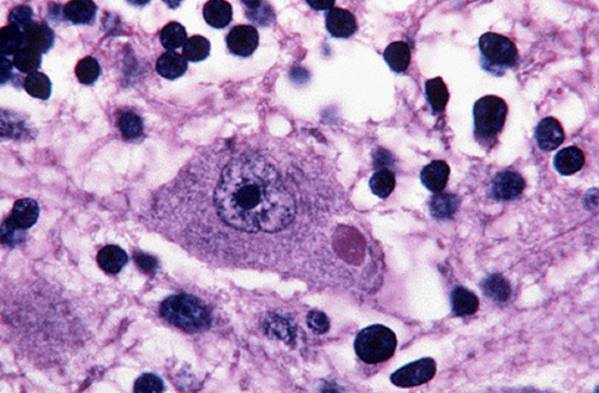
j. Los corpúsculos de Negri se observan como inclusiones
citoplasmáticas generalmente redondas cuyo tamaño oscila entre 0.24 y 0.27 µm de diámetro y color magenta, mientras el resto de la
neurona se observará de color azul.
CONESTE
LAS SIGUIENTES PREGUNTAS
1. En que consiste la tinción modificada de Lentz.
2. ¿Se consideran los corpúsculos de Negri patognomónicos de
la enfermedad de la rabia?
3. Mencione algunas enfermedades que podrían producir otras
inclusiones citoplasmáticas acidófilas.
4. Realice dibujos de sus observaciones.