SISTEMAS BIOLÓGICOS I
MANEJO DE ANIMALES DE
LABORATORIO Y XENODIAGNÓSTICO
INTRODUCCIÓN
Los
animales de experimentación poseen gran importancia para la constante expansión
de los conocimientos en las ciencias médicas. Actualmente en todos los campos
de la ciencia los animales cumplen su papel tanto a través de la investigación,
como para la realización de diversas pruebas de gran utilidad.
Por
ésta y muchas otras razones los animales deben ser empleados siempre dentro de
un marco estricto de principios éticos. Éste tema ha recibido mucha atención y
actualmente existen programas que estimulan el desarrollo de sistemas in-vitro
que sustituyan el uso de animales, sin embargo hay circunstancias en que se
hace inevitable su utilización. Cuando es así, las normas éticas obligan al
investigador a causar el menor
sufrimiento posible a los animales en experimentación. Tales normas han sido de
gran aceptación a nivel de la comunidad científica internacional a tal punto
que su aplicación en proyectos de investigación se considera como requisito
indispensable para su publicación por las revistas científicas.
En
el área de la microbiología la utilización de los animales es bastante amplia
el ejemplo más representativo lo constituye el xenodiagnóstico, que consiste en
reproducir la enfermedad en un animal de laboratorio para observar sus
manifestaciones clínicas y lesiones anatomopatológicas tanto macro como
microscópicamente de los diferentes sistemas. Igualmente se consideran estos
sistemas biológicos de gran utilidad para el mantenimiento y recuperación de
cepas de microorganismos, para la
obtención de componentes plasmáticos en inmunología tales como anticuerpos,
complementos, etc.
OBJETIVOS
1. Conocer la importancia que tienen los animales de
laboratorio en la microbiología
2. Describir diferentes métodos y técnicas de sujeción para
diferentes especies animales.
3. Practicar los métodos más comunes de inoculación en
animales de laboratorio.
MATERIALES
1. Ratones de laboratorio
2. Cámaras para mantenimiento de estas especies.
3. Alimento suficiente para cuatro semanas.
4. Guantes
5. Jeringuillas
6. Agujas calibre 25 a 26
7. Alcohol yodado
8. Algodón
PROCEDIMIENTO
1. Con los dedos pulgar e índice de la mano menos hábil sostener
el ratón en la zona de la nuca y el dorso cuidadosamente de forma que la piel
quede ligeramente tensada, impidiendo que gire su cabeza.
2. Vía intraperitoneal
Para la inoculación intraperitoneal
se recomienda trabajar con animales en ayuno desde la noche anterior para
reducir la posibilidad de una punción visceral.
a. Colocar el ratón con el abdomen hacia arriba y ligeramente
inclinado hacia un costado, para desplaza las vísceras.
b. Realizar la asepsia
c. Realizar la punción en el lado contrario
d. Introduciendo la aguja con un ángulo de 45°
e. Se pueden inocular volúmenes hasta de 2ml.
3. Vía intramuscular
a. Con la ayuda de otro manipulador se extiende sus extremidad
posterior
b. Se realiza la asepsia del área
c. Se realiza la inoculación en la zona del tercio posterior
del muslo
d. Los volúmenes de inoculación admisibles están entre 0.05 a
0.2ml
4. Vía intravenosa, se prefieren ratones adultos que hayan
alcanzado los 20gr de peso
a. Es imprescindible utilizar un dispositivo de sujeción en
forma de tubo donde el animal quedará completamente inmovilizado.
b. Se utilizan las venas causales las cuales deben dilatarse
previamente introduciendo la extremidad caudal en agua a temperatura entre 50 y
55°C durante un minuto antes de la inoculación.
c. Introducir la aguja, con el bisel hacia arriba, de forma
casi paralela a la arteria.
d. El embolo no debe ofrecer resistencia para la inoculación,
lo contrario indicará que la punción no se ha realizado adecuadamente.
e. Debe depositarse lentamente el volumen del inóculo.
f. Se recomienda utilizar volúmenes entre 0.1 a 0.3ml.
5. Vía Intradérmica
a. Se realiza en la piel del abdomen, por lo que puede ser
necesario rasurar previamente.
b. Introducir la aguja, con el bisel hacia arriba, de forma
casi paralela a la piel, la cual debe tensarse previamente para evitar la formación
de arrugas
c. El volumen máximo para esta especie animal es de 0.05ml
d. Para evitar pérdida del volumen inoculado se recomienda
aguja calibre 27 o menor.
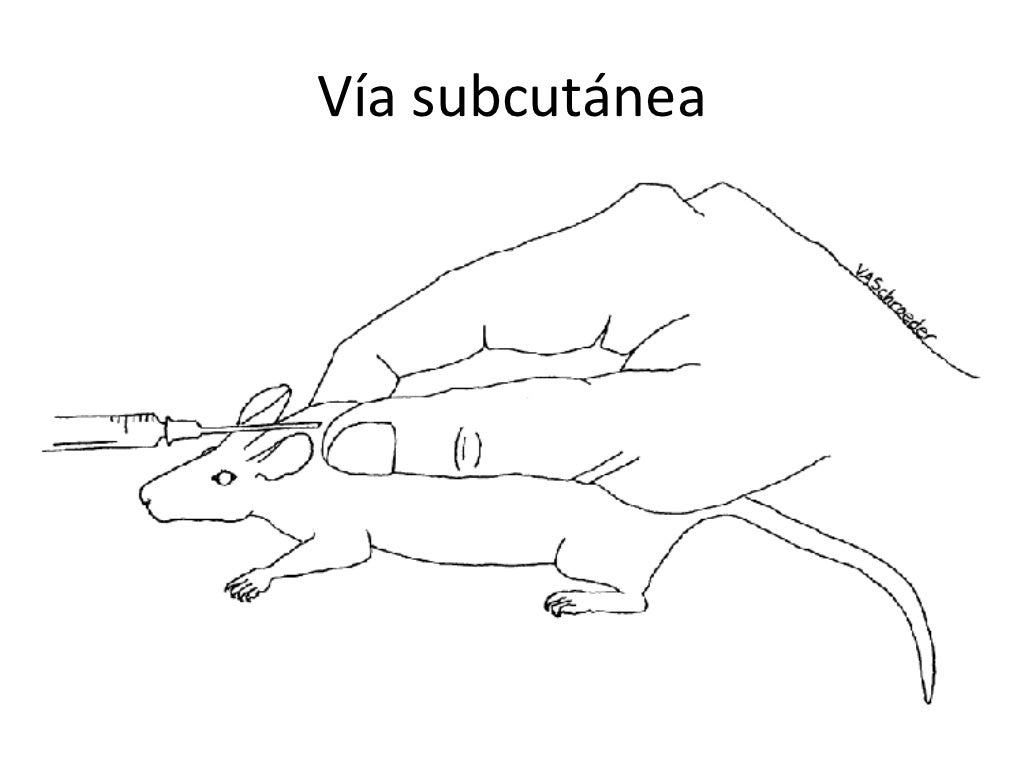
6. Vía subcutánea
a. Se realiza levantando la piel e introduciendo la aguja en
el espacio entre piel y tegumentos.
b. Puede realizarse en el área del dorso, cuello, o entre los
orejas.
c. Admite volúmenes mayores.
NOTA: EL PROFESOR REALIZARÁ DEMOSTRACIONES
PREVIAS DE TODAS LAS TÉCNICAS.
CONTESTE
LAS SIGUIENTES PREGUNTAS
1. Mencione algunas enfermedades que se diagnostican a través del
xenodiagnóstico en nuestro país.
2. Diga que organizaciones u organismos internacionales
regulan la utilización de animales de laboratorio.
3. Como futuro médico veterinario que papel considera que debe
cumplir como profesional en ésta área. Explique
4. Haga un diagrama donde refleje vías de inoculación de elección,
volúmenes de inoculación, calibres de agujas, en las diferentes especies
animales.

No hay comentarios.:
Publicar un comentario